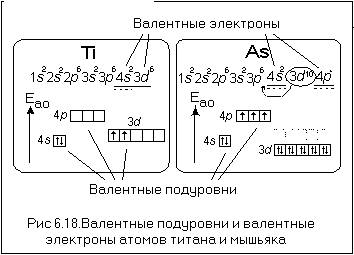
Валентность и количество электронов на наружном уровне – это две важные характеристики, определяющие химические свойства атомов и молекул. Валентность представляет собой число связей, которые атом может образовать с другими атомами. Она обычно определяется числом электронов на внешнем энергетическом уровне, так как именно эти электроны могут участвовать в химических реакциях и образовании связей.
Интересно то, что иногда численное значение валентности и количество электронов на наружном уровне могут расходиться. Это может быть вызвано несколькими факторами. Во-первых, это может быть связано с особенностями электронной конфигурации атома. Некоторые элементы имеют необычные электронные уровни, которые могут приводить к нестандартной валентности. Например, атомы фосфора и серы имеют энергетические уровни, на которых находится больше, чем одна пара электронов, что делает их валентность больше, чем 4.
Во-вторых, причиной расхождения численного значения валентности и числа электронов на наружном уровне может быть наличие свободных электронов. Некоторые атомы имеют свободные электроны, которые не участвуют в химических связях, но они могут влиять на валентность атома. Например, атомы кислорода и азота имеют два свободных электрона, что делает их валентность больше, чем 2.
Причины расхождения валентности и электронов на наружном уровне
1. Комплексная структура атома: Наружный энергетический уровень может иметь свободные или связанные электроны. Количество связанных электронов определяется валентностью атома, в то время как количество свободных электронов на этом уровне может быть меньше или больше валентности.
2. Валентность в ионных соединениях: Валентность атома в ионическом соединении может быть определена по заряду иона. К примеру, валентность атома натрия (Na) в ионическом соединении NaCl равна 1, поскольку ион натрия (Na+) имеет один недостающий электрон на наружном уровне.
3. Валентность в ковалентных соединениях: Валентность атома в ковалентном соединении определяется количеством электронов, которые он может разделить с другими атомами. Например, кислород (O) имеет валентность 2, поскольку он может образовывать две ковалентные связи с другими атомами, разделяя свои два электрона на наружном уровне.
4. Влияние соседних атомов: Некоторые атомы могут изменять свою валентность в результате взаимодействия с соседними атомами. Например, атом кислорода (O) может иметь валентность 1 в перекиси водорода (H2O2), поскольку образуется одна ковалентная связь с другим атомом кислорода, разделяя только один электрон на наружном уровне.
Важно понимать, что валентность и количество электронов на наружном уровне являются связанными, но независимыми характеристиками, которые могут различаться в зависимости от условий и химической структуры атома или молекулы.
Причины расхождения численного значения валентности и числа электронов
Расхождение численного значения валентности и числа электронов на наружном уровне атома связано с особенностями электронного строения вещества. Валентность элемента определяет количество связей, которые атом данного элемента может образовать с другими атомами при создании химических соединений. Она обычно равна количеству электронов на внешнем энергетическом уровне.
Однако, в ряде случаев, численное значение валентности может отличаться от количества электронов на внешнем уровне. Это связано с тем, что внешний энергетический уровень может быть не полностью заполнен или переполнен. В таких случаях может возникать необходимость в образовании ионов или специальных структур, чтобы атом достиг максимальной стабильности.
Например, валентность атомов в основном состоянии обычно соответствует количеству электронов на внешнем уровне, так как атом стремится к заполнению этого уровня в соответствии с правилом октаета. Однако некоторые элементы, такие как огненные атомы (например, фтор), имеют неполный энергетический уровень, поэтому для заполнения его до полного значения, атом может образовывать еще одну или несколько связей. В этом случае, валентность элемента будет больше количества электронов на внешнем уровне.
Также, некоторые элементы могут иметь переполненный внешний энергетический уровень. Например, металлы из группы бора, такие как алюминий, имеют трехэлектронную валентность, несмотря на то, что их внешний энергетический уровень содержит только два электрона. Это связано с возможностью деликвесценции, когда один из электронов переходит на следующий энергетический уровень для устойчивости атома.
Таким образом, расхождение численного значения валентности и числа электронов на внешнем уровне объясняется особенностями электронного строения и потребностью атома в достижении максимальной стабильности.
Нарушение баланса электронной оболочки
Основная причина расхождения численного значения валентности и числа электронов на наружном уровне элемента может быть связана с нарушением баланса электронной оболочки. Каждый атом стремится достичь электронной конфигурации с полностью заполненными уровнями энергии, что делает его более стабильным. Это означает, что атому нужно иметь определенное количество электронов на каждом уровне энергии.
Однако в реальности могут возникать ситуации, когда количество электронов наружного уровня не соответствует его валентности. Это может произойти по нескольким причинам.
| Причина | Объяснение |
|---|---|
| Дефекты кристаллической решетки | В кристаллических материалах, таких как полупроводники или металлы, могут возникать дефекты в кристаллической решетке, где атомы замещены или отсутствуют. Это может привести к изменению количества электронов наружного уровня, что нарушит баланс электронной оболочки и валентности элемента. |
| Ионизация атомов | Атом может лишиться или получить дополнительные электроны в результате ионизации или химических реакций. Например, ионизация металлов может приводить к образованию положительно заряженных ионов, которые имеют меньшее количество электронов наружного уровня, чем исходный атом. |
| Компромиссная электронная конфигурация | Некоторые элементы могут иметь атомы с нестандартными электронными конфигурациями, которые отличаются от обычного порядка заполнения энергетических уровней. Это может привести к несоответствию между валентностью и количеством электронов наружного уровня. |
Все эти факторы могут привести к нарушению баланса электронной оболочки и расхождению между валентностью и числом электронов на наружном уровне элемента. Анализ и понимание этих причин позволяет более глубоко изучить химические свойства и реактивность элементов и их соединений.
Эффекты участия в реакциях
1. Координационные соединения. В них один атом образует связь с несколькими другими атомами, в результате чего число электронных пар у атома может не совпадать с числом валентностей. Примеры таких соединений – комплексы металлов с лигандами.
2. Химические реакции с обменом электронами. В этих реакциях электроны передаются между реагентами. При этом валентность атомов может изменяться, так как электронная структура атомов перестраивается. Примером такой реакции является окислительно-восстановительная реакция.
3. Комплексообразование. В процессе комплексообразования атом или ион образует сложное соединение с другими атомами или ионами. В результате формируются новые химические связи, что может приводить к изменению валентности и числа электронов на наружном уровне.
Эти и другие эффекты участия в реакциях могут быть причиной расхождения численного значения валентности и числа электронов на наружном уровне. Изучение этих эффектов позволяет лучше понять процессы, происходящие во время химических реакций и раскрыть их фундаментальные закономерности.
Внешние факторы, влияющие на валентность
Валентность элемента в химии определяется числом электронов на его наружном энергетическом уровне. Однако, в некоторых случаях наблюдаются расхождения между числом электронов и числом валентных электронов. Эти расхождения могут быть вызваны различными внешними факторами, которые влияют на поведение электронов и их взаимодействие с другими атомами.
Один из таких факторов — окружающая среда. В разных условиях окружающей среды атомы могут вступать в различные химические реакции и образовывать разные соединения. Это может приводить к изменению валентности атомов и, соответственно, к расхождению численного значения валентности и числа электронов на наружном уровне. Например, в присутствии кислорода, некоторые элементы могут образовывать соединения с более высокой валентностью, чем у них самих.
Второй фактор — температура. При повышении температуры энергия атомов и молекул становится выше, что может приводить к изменению их химической активности. Это может вызывать изменение взаимодействия атомов и, как следствие, изменение валентности. Например, некоторые элементы могут иметь разную валентность при разных температурах.
Третий фактор — давление. При изменении давления на атомы и молекулы воздействует сила, которая может изменять их энергетические состояния. В результате этого взаимодействия может происходить изменение валентности элементов. Например, при высоком давлении некоторые элементы могут образовывать соединения с более высокой валентностью.
Таким образом, внешние факторы, такие как окружающая среда, температура и давление, могут влиять на валентность элементов и вызывать расхождение между числом электронов и числом валентных электронов на наружном энергетическом уровне.
Природа расхождения валентности и электронов на наружном уровне
Основной причиной такого расхождения является внутренняя структура атома. Внешний электронный уровень атома может иметь несколько подуровней, каждый из которых может вмещать определенное количество электронов. При распределении электронов по подуровням могут возникать ситуации, когда некоторые подуровни наружного уровня оказываются полностью заполненными, в то время как другие подуровни остаются незаполненными или частично заполненными.
Такая структура электронного уровня приводит к тому, что численное значение валентности может отличаться от числа электронов на наружном уровне. Например, элемент с числом электронов на наружном уровне равным 3 может иметь валентность 2 из-за того, что один из подуровней наружного уровня полностью заполнен.
Также расхождение валентности и числа электронов на наружном уровне может быть обусловлено эффектами связи и поляризации атомов в молекуле. Взаимодействие атомов может приводить к изменению электронной структуры и валентности атомов.
Атомы с полными электронными оболочками
Однако, существуют атомы, у которых валентность и число электронов на наружном уровне не совпадают. Такое расхождение может быть объяснено наличием полных электронных оболочек. В этом случае, атом уже достиг полного электронного состояния и не имеет потребности в обмене электронами с другими атомами. Такие атомы считаются стабильными и не образуют химические связи с другими атомами.
Примером таких атомов являются инертные газы, такие как гелий, неон, аргон и другие элементы из группы благородных газов в периодической системе. У них на наружном энергетическом уровне находится полное количество электронов, что делает их стабильными и не имеющими потребности в химических реакциях.
Важно отметить, что наличие полного электронного состояния не является единственной причиной расхождения численного значения валентности и числа электронов на наружном уровне. Другие факторы, такие как эффекты критического радикала и необычная электронная структура, также могут оказывать влияние на расхождение.
Возможное наличие свободных электронов
Наличие свободных электронов обусловлено структурой некоторых материалов, таких как металлы. В металлах электроны находятся в общей зоне проводимости, что позволяет им свободно перемещаться и образовывать электрический ток.
Однако, валентность атома, как правило, определяется числом электронов на его наружном уровне. Число электронов на внешнем уровне атома соответствует валентности и определяет его химические свойства и возможность взаимодействия с другими атомами.
Таким образом, наличие свободных электронов может вызывать расхождение численного значения валентности и числа электронов на наружном уровне. В металлах, например, число свободных электронов насчитывает много больше, чем число электронов на внешнем уровне атома.
Это расхождение объясняет способность металлов проводить электрический ток и обладать специфическими физическими свойствами, отличными от свойств неметаллических элементов.
Вопрос-ответ:
Почему может возникать расхождение численного значения валентности и числа электронов на наружном уровне?
Расхождение численного значения валентности и числа электронов на наружном уровне может возникать из-за различных факторов. Например, это может быть связано с наличием свободных электронов в проводимости или с присутствием дополнительных электронов на внешнем уровне атома. Также, редактирование молекул, атомов и ионов по его неделимым структурным единицам: <<частицы>>.
Какие факторы могут привести к расхождению численного значения валентности и числа электронов на наружном уровне?
Расхождение численного значения валентности и числа электронов на наружном уровне может быть вызвано наличием необычного спина электронов, атомными дефектами, неидеально сформированными структурами и другими факторами, влияющими на электронную структуру атомов.
Какие примеры привести к расхождению численного значения валентности и числа электронов на наружном уровне?
Примером расхождения численного значения валентности и числа электронов на наружном уровне может служить атом железа, у которого в наружном энергетическом уровне находятся два электрона, но валентность этого атома составляет три. Это связано с возможностью атома железа формировать соединения с тремя другими атомами.
Какие последствия может иметь расхождение численного значения валентности и числа электронов на наружном уровне?
Расхождение численного значения валентности и числа электронов на наружном уровне может привести к изменению химических свойств вещества или ионного радикала. Это может влиять на его реакционную способность и способность образовывать химические связи с другими веществами.
Каким образом происходит изучение расхождений численного значения валентности и числа электронов на наружном уровне?
Изучение расхождений численного значения валентности и числа электронов на наружном уровне проводится с использованием различных методов и технологий, включая рентгеноструктурный анализ, спектроскопию и другие физические и химические методы исследования. Также применяются теоретические расчеты и моделирование электронных структур.
Почему может быть расхождение между численным значением валентности и числом электронов на наружном уровне?
Расхождение между численным значением валентности и числом электронов на наружном уровне может возникать из-за различных причин. Одной из основных причин является наличие «возможных» электронов, то есть электронов, которые могут быть задействованы в химических реакциях, но фактически находятся на других энергетических уровнях. Также, в некоторых случаях, электроны могут быть переданы или получены при взаимодействии атомов, что приводит к изменению числа электронов на наружном уровне без изменения валентности.